
Methämoglobin ist Hämoglobin, bei dem das Eisen der Hämgruppe zur Wertigkeit +3 oxidiert ist. Methämoglobin bindet keinen Sauerstoff. Im Stoffwechsel entstehen ständig geringe Mengen MetHb, dieses wird normalerweise durch die erythrozytäre Methämoglobinreduktase unter dem Verbrauch von NADH zu Hämoglobin reduziert. Dadurch zirkuliert nur etwa 1% MetHb. Dieses System ist bei der Geburt noch nicht entwickelt und erreicht erst in den ersten Lebensmonaten seine volle Aktivität.
Man kann folgende Methämoglobinämien unterscheiden:
- Enzymopathische Variante, durch einen hereditären Defekt der MetHb-Reduktase (Gibson-Syndrom)
Betroffen ist die NADH-Cytochrom b5-Reduktase, das wichtigste Enzym des Systems. Neben der Reduktion von Methämoglobin spielt sie auch eine Rolle im Stoffwechsel der Fettsäuren. Der Defekt kann auf die Erythrozyten beschränkt sein und den Patienten ein fast normales Leben führen lassen. Er kann sich aber auch in allen Geweben und Organen manifestieren. Diese Form ist sehr viel schwerer und führt mit zahlreichen Entwicklungsstörungen zum Tod im Kindesalter.
- Hämoglobinopathische Variante, durch Vorliegen von Hämoglobin M (Hörlein-Weber-Syndrom)
Unter der Bezeichnung "HbM" werden fünf Varianten des Adulthämoglobins zusammengefasst, die spontan Methämoglobin bilden. Dies sind: HbM Boston (Alpha 58 His => Tyr), HbM Iwate (Alpha 87 His => Tyr), HbM Saskatoon (Beta 63 His => Tyr), HbM Milwaukee (Beta 67 Val => Glu) und HbM Hyde Park (Beta 92 His => Tyr).
Hb Zürich (Beta 63 His => Arg) bildet ebenfalls Methämoglobin, aber erst nach Kontakt mit oxidierenden Substanzen.
Auch für das fetale Hämoglobin sind zwei Punktmutationen in der gamma-Kette bekannt, die zur Bildung von Methämoglobin führen: Hb FM Osaka (Gamma 63 His => Tyr) und Hb FM Fort Ripley (Gamma 92 His => Tyr).
- Toxisch durch:
- Oxidationsmittel: Chlorat, Perchlorat u.a.
- Nitrite: Nitroglyzerin, Nitrit, Nitrat, Amylnitrat u.a.
- aromatische Amino- und Nitroverbindungen: Phenacetin, Anilin, Sulfonamide, Nitrobenzol u.a.
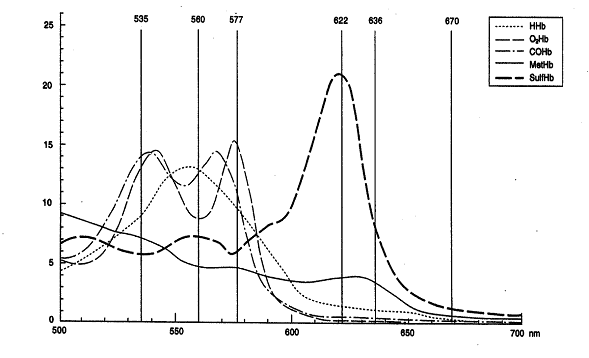
Die Abbildung zeigt die Spektren der verschiedenen Hämoglobinarten.
Die Oxymetrie-Parameter Deoxyhämoglobin (HHb), Oxyhämoglobin (O2Hb), Methämoglobin (MetHb) und CO-Hämoglobin (COHb) zeigen im Bereich zwischen 500 und 700 nm unterschiedliche Absorptionsspektren. Der ABL 837 misst die Absorption der hämolysierten Blutprobe bei 128 Wellenlängen und berechnet daraus mit Hilfe der molaren Extinktionskoeffizienten das totale Hämoglobin in g/l sowie die Fraktionen Deoxyhämoglobin, Oxyhämoglobin, fetales Hämoglobin, Methämoglobin und CO-Hämoglobin in % des totalen Hb. | 
|