
Immunglobuline (Ig) werden von B-Lymphozyten verschiedener Reifungsstadien produziert und bilden mit ihnen das humorale Immunsystem. Sie werden als Antwort auf den Kontakt mit einem Antigen (einem körperfremden Makromolekül oder einer fremden Zellstruktur) produziert. Ihre Aufgabe ist es, das Antigen zu binden und bei seiner Unschädlichmachung zu helfen: sei es bei löslichen Antigenen durch Neutralisierung, bei zellgebundenen Antigenen durch Einleiten der Phagozytose oder des "Angriffs" des Komplementsystems.
Man schätzt, dass der menschliche Körper etwa 108 "vorgefertigte" Immunglobuline besitzt, die jedes erdenkliche Antigen binden können. Jedes dieser Ig wird von mindestens einem bestimmten B-Lymphozyten produziert. Beim Kontakt mit dem passenden Antigen vermehrt sich ein B-Lymphozyt zu einem Klon von Plasmazellen, die grosse Mengen ihres spezifischen Immunglobulins ins Blut abgeben. Eine Plasmazelle kann im Laufe ihres Lebens die Immunglobulinklasse wechseln, die Antigenspezifität bleibt jedoch immer dieselbe.
Alle Immunglobulinmoleküle haben eine gemeinsame Grundstruktur. Diese besteht aus 2 schweren und 2 leichten Ketten, die ungefähr in Form eines Y angeordnet sind. Man unterscheidet den Fab-Teil des Moleküls, der das Antigen bindet, und den Fc-Teil, der an Oberflächenrezeptoren auf manchen Zellen binden kann. Der Fc-Teil enthält ausserdem Bindungsstellen für Proteine des Komplementsystems: durch Bindung der Komponente C1q wird das Komplementsystem aktiviert.
Die Immunglobuline lassen sich nach der chemischen Struktur der schweren Ketten und nach ihrer Funktion in 5 Klassen einteilen: IgA, IgG, IgM, IgD und IgE.
Die entsprechenden schweren Ketten gibt es demnach 5 Varianten: sie werden Alpha, Gamma, Mü, Delta und Epsilon genannt. Die leichten Ketten gibt es in 2 Ausgaben: Kappa und Lambda. Schwere und leichte Ketten können beliebig miteinander kombiniert werden; ein Immunglobulin enthält aber immer nur eine Art von schweren und leichten Ketten.
Grundstruktur der verschiedenen Immunglobulinklassen:
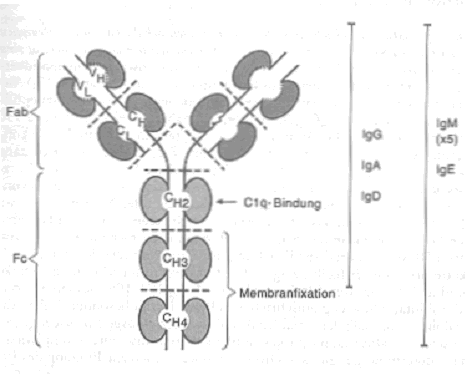
Sowohl schwere wie leichte Ketten haben einen konstanten und einen variablen Teil. Der variable Teil der schweren (VH) und der leichten Ketten (VL) ist für die Bindung des Antigens zuständig: Aminosäuresequenz und räumliche Struktur müssen zum jeweiligen Antigen passen. Der konstante Teil der schweren Ketten wird als CH bezeichnet, der der leichten Ketten als CL. Sowohl schwere wie leichte Ketten bestehen aus mehreren Domänen, sich wiederholenden schleifenartigen Strukturen von etwa 110 Aminosäuren Länge, die in der Abbildung grau dargestellt sind.
IgG sind Monomere mit einem Molekulargewicht von rund 150'000 Dalton. Ihre schweren Ketten (Gamma-Ketten) bestehen aus 4 Domänen, die leichten aus 2 Domänen. Je eine davon entfällt auf den variablen Teil.Man unterscheidet beim IgG nach Struktur und Funktion die Subklassen IgG1 bis IgG4.
Halbwertszeit von IgG: subklassenspezifisch, im Mittel 21 Tage
Monoklonale und polyklonale Immunglobuline: Die Bestimmung der Gesamt-Immunglobuline sagt nicht aus, ob es sich um monoklonales oder polyklonales Ig handelt. Diese wichtige Auskunft liefern ergänzend die Proteinelektrophorese und/oder die Immunfixation.
Das Serum enthält normalerweise eine Mischung von Ig-Molekülen, die von zahlreichen verschiedenen B-Lymphozyten oder Plasmazellen stammen und sich in ihrer Klasse und in ihrem variablen Teil unterscheiden. Dieses polyklonale Ig erscheint in der Elektrophorese und in der Immunfixation als breite Bande. Entartet dagegen ein B-Lymphozyt oder eine Plasmazelle zu einem malignen Klon, so stellen alle seine Tochterzellen haargenau dasselbe Ig-Molekül her. In der Elektrophorese und in der Immunfixation zeigt sich monoklonales Ig als schmale, intensiv gefärbte Bande, in der densitometrischen Auswertung als schmaler Peak ("M-Gradient"). Monoklonale Ig sind typisch für multiple Myelome und für M. Waldenström. |