
Methämoglobin ist Hämoglobin, bei dem das Eisen der Hämgruppe zur Wertigkeit +3 oxidiert ist. Methämoglobin bindet keinen Sauerstoff. Im Stoffwechsel werden ständig kleine Mengen Methämoglobin gebildet und durch das Methämoglobinreduktase-System, das aus mehreren Enzymen besteht, mit Hilfe von NADH oder Glutathion wieder reduziert. Dieses System ist bei der Geburt noch nicht entwickelt und erreicht erst in den ersten Lebensmonaten seine volle Aktivität.
Methämoglobin bildet sich bei Vergiftungen mit oxidierenden Substanzen wie Paracetamol, Sulfonamiden, Nitraten, Nitriten, Na-Nitroprussid, Nitroglycerin, nitrosen Gasen (NO, NO2), Lacken, Farben.
Genetisch bedingte Methämoglobinämien lassen sich in zwei Kategorien einteilen: (1), (2)
- Hämoglobinvarianten: Unter der Bezeichnung "HbM" werden fünf Varianten des Adulthämoglobins zusammengefasst, die spontan Methämoglobin bilden. Dies sind: HbM Boston (Alpha 58 His => Tyr), HbM Iwate (Alpha 87 His => Tyr), HbM Saskatoon (Beta 63 His => Tyr), HbM Milwaukee (Beta 67 Val => Glu) und HbM Hyde Park (Beta 92 His => Tyr).
Hb Zürich (Beta 63 His => Arg) bildet ebenfalls Methämoglobin, aber erst nach Kontakt mit oxidierenden Substanzen.
Auch für das fetale Hämoglobin sind zwei Punktmutationen in der gamma-Kette bekannt, die zur Bildung von Methämoglobin führen: Hb FM Osaka (Gamma 63 His => Tyr) und Hb FM Fort Ripley (Gamma 92 His => Tyr).
- Defekte des Methämoglobinreduktase-Systems: Betroffen ist die NADH-Cytochrom b5-Reduktase, das wichtigste Enzym des Systems. Neben der Reduktion von Methämoglobin spielt sie auch eine Rolle im Stoffwechsel der Fettsäuren. Der Defekt kann auf die Erythrozyten beschränkt sein und den Patienten ein fast normales Leben führen lassen. Er kann sich aber auch in allen Geweben und Organen manifestieren. Diese Form ist sehr viel schwerer und führt mit zahlreichen Entwicklungsstörungen zum Tod im Kindesalter (1).
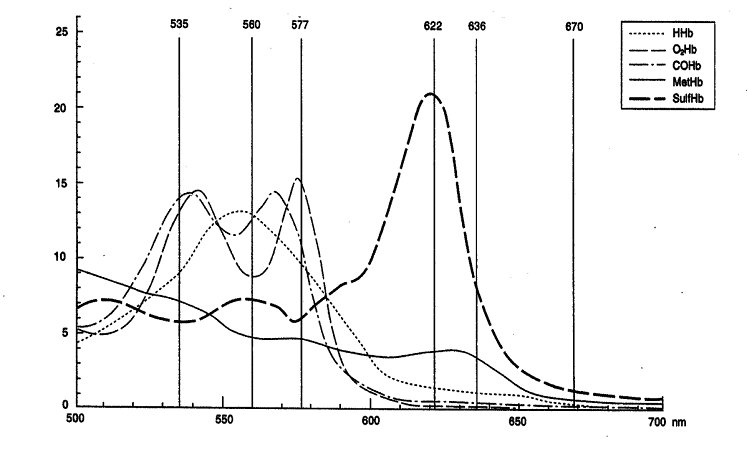
Die Abbildung zeigt die Spektren der verschiedenen Hämoglobinarten.
Die Oxymetrie-Parameter Deoxyhämoglobin (HHb), Oxyhämoglobin (O2Hb), Methämoglobin (MetHb) und CO-Hämoglobin (COHb) zeigen im Bereich zwischen 500 und 700 nm unterschiedliche Absorptionsspektren. Der ABL 725 misst die Absorption der hämolysierten Blutprobe bei 128 Wellenlängen und berechnet daraus mit Hilfe der molaren Extinktionskoeffizienten das totale Hämoglobin in g/L sowie die Fraktionen Deoxyhämoglobin, Oxyhämoglobin, fetales Hämoglobin, Methämoglobin und CO-Hämoglobin in % des totalen Hb.
Einzelheiten siehe Blutgase [Li-Heparin-Vollblut] | 
|